Ο Δημόκριτος (450 π.Χ.) και ο Dalton (1800 μ.Χ.) διατύπωσαν στις θεωρίες τους ότι η μακροσκοπική ύλη αποτελείται από μικρότερα σωματίδια και ότι υπάρχει ένα έσχατο σημείο διαίρεσης της ύλης που το ονόμασαν άτομο. Οπότε μπαίνει το ερώτημα: «Τα άτομα έχουν εσωτερική δομή;». Το 19ο αιώνα οι επιστήμονες πίστευαν ότι δεν έχουν, για να αποδειχτεί το 1896 ότι είχαν άδικο.
Από το 1833 οι φυσικοί γνώριζαν και μελετούσαν τις ηλεκτρικές εκκενώσεις σε αέρια. Ο Faraday χρησιμοποιούσε αρκετά αυτή τη μέθοδο σε μια διαδικασία διάσπασης μιας ουσίας με τη βοήθεια ηλεκτρικού ρεύματος που ονόμαζε ηλεκτρόλυση. Είχε βρεί μάλιστα ότι η μάζα ενός στοιχείου που αποτίθεται σε ένα ηλεκτρόδιο είναι ανάλογη προς τη μάζα, το ατομικό βάρος, το φορτίο και αντιστρόφως ανάλογη προς το σθένος του. Ουσιαστικά είχε προβλέψει ότι η ύλη αποτελείται από θετικά και αρνητικά φορτία και μάλιστα το φορτίο αυτό είναι κβαντωμένο1. Δηλαδή υπάρχει μόνο σε διακριτές οντότητες, ακέραια πολλαπλάσια μιας θεμελιώδους μετρήσιμης ποσότητας, που σήμερα είναι γνωστό ως φορτίο του ηλεκτρονίου. Την ιδέα του αρνητικού και θετικού ηλεκτρικού φορτίου την είχε προτείνει νωρίτερα (18ος αιώνας) ο Βενιαμίν Φραγκλίνος
Το 1838 ο Faraday πέρασε ηλεκτρικό ρεύμα μέσω ενός γυάλινου σωλήνα που περιείχε αραιωμένο αέρα (αέρας σε χαμηλή πίεση). Στη διάρκεια του πειράματος παρατήρησε ακτινοβολία μεταξύ της ανόδου (θετικό ηλεκτρόδιο) και της καθόδου (αρνητικό ηλεκτρόδιο), εκτός από κάποιες περιοχές κοντά στην άνοδο. Οι περιοχές αυτές ονομάστηκαν από τον Crookes «καθοδικές σκοτεινές περιοχές»2. Ο Julius Plucker το 1859 τοποθέτησε ένα μαγνήτη μπροστά από την κάθοδο και παρατήρησε ότι η εκκένωση μετατοπιζόταν ενώ το τμήμα απέναντι από την κάθοδο φθόριζε με ένα έντονο πράσινο χρώμα. Ο φθορισμός αποδόθηκε στην ακτινοβολία που ονομάστηκε «καθοδική ακτίνα»3 από τον E. Goldstein το 1876.
Σχήμα 1 Πειραματική διάταξη Goldstein
Για αρκετό καιρό οι επιστήμονες δεν μπορούσαν να συμφωνήσουν για τη φύση του φαινομένου. Ο Herz το 1892 ισχυριζόταν ότι οι καθοδικές ακτίνες δεν θα μπορούσαν να είναι σωματίδια, έτσι θα έπρεπε να ήταν κύματα. Οι Crookes, Kelvin, Thomson επέμεναν ότι οι ακτίνες ήταν φορτισμένα σωμάτια. Έτσι αναπτύχθηκαν δύο σχολές: η γερμανική που υποστήριζε την κυματική φύση και η αγγλική που υποστήριζε την σωματιδιακή φύση των καθοδικών ακτίνων.
Το 1895 στο Παρίσι, ο Γάλλος φυσικός Jean Baptiste Perrin απέδειξε ότι οι καθοδικές ακτίνες ήταν αρνητικά φορτισμένα σωματίδια4. Σε ένα σωλήνα υψηλού κενού οδήγησε τις καθοδικές ακτίνες σε έναν κλωβό Faraday και εκεί βρήκε ότι μετέφεραν ηλεκτρικό φορτίο. Επίσης είχαν την ιδιότητα να εκτρέπονται από το μαγνητικό πεδίο. Με αυτό το πείραμα ο Perrin άνοιξε το δρόμο για την εύρεση του ηλεκτρονίου, που σαν όρος προτάθηκε το 1894 από τον J. Stoney. Ο Stoney παρήγαγε τον όρο «ηλεκτρόνιο» και τον απέδωσε στο φορέα της «ηλεκτρικής δύναμης» που είχε ορίσει περίπου 300 χρόνια πριν ο William Gilbert. Ο Γκίλμπερτ είχε μελετήσει τον στατικό ηλεκτρισμό χρησιμοποιώντας ήλεκτρο, απ' όπου και όρισε τη σχετική δύναμη.
Σχήμα 2 Εκτροπή καθοδικών ακτίνων σε κλωβό Faraday από μαγνητικό πεδίο
Το 1896 ο P. Zeeman βρήκε ότι οι γραμμές στο φάσμα εκπομπής του νατρίου διαχωρίζονταν, όταν η πηγή του φωτός βρισκόταν μέσα σε ισχυρό μαγνητικό πεδίο. Συγχρόνως, παρατήρησε ότι οι φασματικές γραμμές ήταν πολωμένες. Το φαινόμενο αυτό ονομάστηκε Zeeman5. Ο Zeeman πρότεινε ότι το φως εκπεμπόταν από κινούμενα ηλεκτρικά φορτισμένα σωματίδια (τα ηλεκτρόνια) που βρίσκονται μέσα στο άτομο κι όχι από το ίδιο το άτομο. Γι' αυτό και η κίνηση τους επηρεαζόταν από το μαγνητικό πεδίο, σύμφωνα με τους νόμους του κλασσικού ηλεκτρομαγνητισμού. Από τη μεταβολή της συχνότητας του εκπεμπόμενου φωτός οι Zeeman και Lorentz υπολόγισαν το λόγο e/m, το ειδικό φορτίο των σωματιδίων που προκαλούσαν την εκπομπή του φωτός και βρήκαν ότι το φορτίο τους ήταν αρνητικό. Ο Zeeman μαζί με το H. Lorentz κέρδισαν το Νόμπελ Φυσικής το 1902 για την ανακάλυψη της επίδρασης του μαγνητισμού στην ακτινοβολία.
Το 1897 λόγος e/m προσδιορίστηκε πειραματικά από τον J. J. Thomson και συμφωνούσε με την τιμή που είχαν προβλέψει οι Zeeman-Lorentz: 1,6 × 10−19 C. Ο Thomson όμως διαπίστωσε ότι αυτή η τιμή ήταν σταθερή για όλα τα άτομα ανεξάρτητα από το υλικό από το οποίο προέρχονταν. Ήταν επομένως ένα συστατικό όλων των ατόμων, ένα καθολικό χαρακτηριστικό σωμάτιο της ύλης. Ο Τόμσον ήταν ο πρώτος που παρατήρησε την εκτροπή των καθοδικών ακτίνων από ηλεκτρικό πεδίο, αφού η εκτροπή τους από μαγνητικό πεδίο ήταν ήδη γνωστή. Ο Τόμσον παρήγαγε στενές δέσμες καθοδικών ακτίνων και μέτρησε την απόκλιση τους σε ηλεκτρικά και μαγνητικά πεδία. Κατέληξε στο συμπέρασμα ότι ο βαθμός εκτροπής εξαρτώνταν από τρεις παράγοντες: τη μάζα των σωματίων, την ταχύτητα τους, και το ηλεκτρικό τους φορτίο6.
Σχήμα 3 Πειραματική διάταξη Thomson
Όσο μεγαλύτερη είναι η μάζα του κάθε σωματίου, τόσο μεγαλύτερη είναι και η αδράνεια του, και επομένως τόσο μικρότερη η εκτροπή. Όσο μεγαλύτερο είναι το φορτίο του κάθε σωματίου, τόσο μεγαλύτερη είναι και η δύναμη που ασκείται σε αυτό, και άρα τόσο μεγαλύτερη και η εκτροπή. Τέλος, όσο μεγαλύτερη είναι η ταχύτητα του σωματίου, τόσο μικρότερη είναι η εκτροπή. Επιπλέον, ο Τόμσον ήταν σε θέση να αποδείξει, με βάση τα πειραματικά του δεδομένα, ότι η μάζα των σωματίων ήταν πολύ μικρότερη από αυτήν οποιουδήποτε ατόμου. Σύντομα μετά την ανακοίνωση των αποτελεσμάτων αυτών, το σωμάτιο των καθοδικών ακτίνων ονομάστηκε ηλεκτρόνιο6.
Το 1899 θέλησε να μετρήσει ξεχωριστά το φορτίο και τη μάζα του ηλεκτρονίου. Αυτό έγινε με τη βοήθεια του θαλάμου νέφωσης του Wilson. Για την εύρεση του φορτίου του ηλεκτρονίου χρησιμοποίησε τη μέθοδο κατά την οποία τα φορτία ενεργώντας σαν πυρήνες συμπύκνωσης υπέρκορων ατμών, σχηματίζουν σταγονίδια μέσα σε θαλάμους με υπέρκορους υδρατμούς. Γι’ αυτό και η μέθοδος αυτή ονομάστηκε μέθοδος της σταγόνας. Κάθε ηλεκτρικό φορτίο συμπυκνώνει γύρω του ένα τέτοιο σταγονίδιο. Μέσω της πειραματικής εύρεσης της ταχύτητας πτώσης των σταγόνων μπόρεσε να υπολογίσει τον όγκο τους. Μετρώντας στη συνέχεια την συνολική μάζα του νερού που συμπυκνώνεται βρήκε και το πλήθος των σταγονιδίων, που περιέχει το νέφος. Μετρώντας επίσης απευθείας το ολικό φορτίο του νέφους μπορεί να προσδιοριστεί το φορτίο ενός μέσου σταγονιδίου, που είναι ίσο με το στοιχειώδες ηλεκτρικό φορτίο, το φορτίο του ηλεκτρονίου7.
Στη συνέχεια μέτρησε το λόγο του φορτίου προς τη μάζα του σωματιδίου και τη βρήκε ίση με το 1/1800 της μάζας ενός ατόμου υδρογόνου. Ήταν πάρα πολύ μικρή σε σχέση με τη μάζα των ατόμων. Αυτό ήταν μία ένδειξη για την ύπαρξη εσωτερικής δομής στα άτομα. Για την ανακάλυψη του ηλεκτρονίου, ο J.J. Thomson τιμήθηκε με το βραβείο Νομπέλ Φυσικής το 1906.
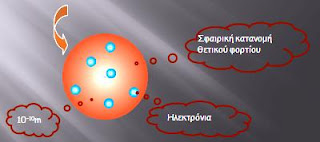
Δύο χρόνια νωρίτερα ο Thomson διατύπωσε την ατομική θεωρία του σύμφωνα με την οποία τα υποατομικά σωματίδια ήταν αρνητικά φορτισμένα ηλεκτρόνια που ήταν ελεύθερα μέσα σε μια θετικά φορτισμένη ύλη, ώστε το άτομο να παραμένει ουδέτερο. Η εικόνα ενός τέτοιου ατόμου μοιάζει με πουτίνγκα γι΄αυτό και πήρε την ονομασία “pudding model”8.
Σχήμα 4 Ατομικό πρότυπο Thomson
Ο ακριβής προσδιορισμός του ηλεκτρικού φορτίου έγινε από τον Milikan το 1911. Ο Milikan βελτίωσε την πειραματική μέθοδο του Thomson χρησιμοποιώντας σταγόνες λαδιού σε ηλεκτρικό πεδίο πυκνωτή. Το πείραμα των σταγόνων του λαδιού ήταν η πρώτη άμεση και πειστική μέτρηση του ηλεκτρικού φορτίου ενός ηλεκτρονίου. Χρησιμοποιώντας έναν ψεκαστήρα αρώματος ψέκασε σταγόνες λαδιού μέσα σε έναν διαφανή θάλαμο. Στην κορυφή και στη βάση του θαλάμου υπήρχαν μεταλλικές πλάκες συνδεδεμένες με μπαταρία δημιουργώντας έναν θετικό και έναν αρνητικό πόλο. Εφόσον κάθε σταγονίδιο λάμβανε ένα ελάχιστο φορτίο στατικού ηλεκτρισμού καθώς ταξίδευε στον αέρα, η ταχύτητα της κίνησής του μπορούσε να ελεγχθεί με αλλαγές της τάσης στις δύο πλάκες. Όταν ο χώρος μεταξύ των δύο πλακών ιονίζεται με ακτινοβολία, τα ηλεκτρόνια του αέρα κολλάνε στα σταγονίδια του λαδιού προσδίδοντάς τους αρνητικό φορτίου. Ο Milikan παρατήρησε πολλά σταγονίδια μεταβάλλοντας την τάση και ελέγχοντας το αποτέλεσμα. Μετά από πολλές επαναλήψεις συμπέρανε ότι το φορτίο μπορεί να λάβει μόνο κάποιες συγκεκριμένες τιμές. Έτσι απέδειξε ότι το φορτίο είναι κβαντωμένο9. Οι μικρότερες από τις τιμές αυτές αντιστοιχούν στο φορτίο του ηλεκτρονίου. Από το λόγο e/m υπολόγισε και τη μάζα του ηλεκτρονίου.
Το επόμενο κλασσικό πρότυπο ατόμου ήταν το πλανητικό μοντέλο του Rutherford. Ο φυσικός Ernest Rutherford με τους μαθητές του Hans Geiger και Ernst Marsden πραγματοποίησαν ένα πείραμα που είχε διαφορετικά αποτελέσματα από τα αναμενόμενα με βάση το μοντέλο του Thomson. Ο Ράδερφορντ με το πείραμα του έδειξε ότι το μεγαλύτερο μέρος του ατόμου είναι κενός χώρος και η περισσότερη μάζα του είναι συγκεντρωμένη στην κεντρική περιοχή του, όπου ονομάστηκε πυρήνας. Κατεύθυνε σε ένα πολύ λεπτό φύλλο χρυσού μία δέσμη σωματιδίων άλφα, η οποία προερχόταν από ραδιενεργή πηγή και μέτρησε τη γωνία εκτροπής των σωματιδίων απ' την τροχιά τους, όταν εξέρχονταν από το άλλο μέρος του φύλλου Au. Τη γωνία εκτροπής τη μέτρησε παρατηρώντας τις φωτεινές κηλίδες που σχηματίζονταν πάνω σε διάφραγμα από θειούχο ψευδάργυρο με το οποίο είχε περιβάλλει το φύλλο χρυσού.
Ο Ράδερφορντ παρατήρησε ότι τα περισσότερα σωματίδια συνέχιζαν μία περίπου ευθύγραμμη τροχιά διαμέσου του λεπτού φύλλου χρυσού. Όμως ορισμένα εκτρέπονταν σε πολύ μεγάλο βαθμό και μάλιστα μερικά σκεδάζονταν προς τα πίσω, στη διεύθυνση πρόσπτωσης. Με αυτό το πείραμα ο Ράδερφορντ συμπέρανε ότι τα σωματίδια που δεν εκτρέπονταν περνούσαν μέσα από περιοχές του φύλλου χρυσού που ήταν κενός χώρος, ενώ τα σκεδαζόμενα σωματίδια απωθούνταν από το κέντρο κάθε ατόμου Au, που ήταν φορτισμένο θετικά, όπως τα σωματίδια α και τον ονόμασε πυρήνα του ατόμου10.
Σχήμα 5 Πειραματική διάταξη Rutherford
Έτσι ο Ράδερφορντ κατέληξε στο συμπέρασμα ότι όλο το θετικό φορτίο και σχεδόν όλη η μάζα του ατόμου βρίσκονται στον πυρήνα του, ενώ τα ηλεκτρόνια περιστρέφονται όπως οι πλανήτες γύρω από τον πυρήνα, σε μη καθορισμένες τροχιές.
Σχήμα 6 Πλανητικό μοντέλο Rutherford
Οι αδυναμίες του μοντέλου του Rutherford είναι οι εξής:
• Οι τυχαίες τροχιές των ηλεκτρονίων δεν μπορούν να ερμηνεύσουν τις συγκεκριμένες ιδιότητες των ατόμων των στοιχείων.
• Είναι σε αντίθεση με την «ηλεκτρομαγνητική θεωρία», όπου κάθε ηλεκτρόνιο που επιταχύνεται (λόγω κυκλικής κίνησης) εκπέμπει ενέργεια με μορφή ηλεκτρομαγνητικών κυμάτων (ακτινοβολίες) συνεχούς φάσματος,
• Κινείται σπειροειδώς προς τον πυρήνα εφόσον έλκεται από το θετικό του φορτίου με συνέπεια να καταστρέφεται το άτομο.
Σχήμα 7 Κλασσικά ατομικά πρότυπα
Ήταν προφανές ότι τα κλασσικά πρότυπα δεν έδιναν ρεαλιστικές ερμηνείες για το εσωτερικό των ατόμων. Το 1913 ο δανός φυσικός Bohr ανέπτυξε ένα ατομικό μοντέλο που συνδύαζε εκείνο του Rutherford με μια νέα σωματιδιακή θεωρία, την κβαντική. Το πρότυπο Bohr ερμήνευσε χοντρικά τα φάσματα εκπομπής και απορρόφησης του υδρογόνου. Το μοντέλο αυτό αναδύθηκε από την επιδίωξη του εμπνευστή του να αποδώσει σταθερότητα στο πλανητικό μοντέλο του ατόμου του Rutherford. Προσπάθησε να ενσωματώσει στις στάσιμες καταστάσεις (τροχιές) του Rutherford την έννοια της κβάντωσης της ενέργιας. Έτσι κατέληξε στις εξής παραδοχές:
• Τα ηλεκτρόνια περιστρέφονται γύρω από τον πυρήνα υπο την επίδραση της δύναμης Coulomb του πυρήνα σε κυκλικές τροχιές. (κλασσική παραδοχή)
• Οι επιτρεπόμενες τροχιές έχουν κβαντισμένη ενέργια
• Η συχνότητα της ακτινοβολίας που εκπέμπεται/απορροφάται σε μια μετάπτωση μεταξύ δυο τροχιών δίνεται από την ενεργιακή διαφορά τους διαιρεμένη με τη σταθερά Plank. (Ο λεγόμενος κανόνας της συχνότητας: ΔΕ=h∙f)
 |
| Σχήμα 8 Γραμμικά φάσματα ατόμων |
Ο Bohr προκειμένου να συνδυάσει αυτές τις δύο ασυμβίβαστες θεωρίες εισήγαγε την Αρχή της Αντιστοιχίας σύμφωνα με την οποία «η κβαντική δίνει τα ίδια αποτελέσματα με την κλασσική στα όρια πολύ μεγάλων κύριων κβαντικών αριθμών n». Για το άτομο του υδρογόνου με τιμή n=1000 αντιστοιχεί τροχιά περίπου 1cm και ενεργιακά είναι πολύ κοντά στην ενέργια ιοντισμού.
Τα μειονεκτήματα της θεωρίας του Bohr ήταν τα εξής:
• Δεν εξηγούσε τη λεπτή υφή του φάσματος υδρογόνου. Αυτή εξηγήθηκε αργότερα από τον Sommerfeld με τη σχετικιστική φυσική
• Δεν μπόρεσε να ερμηνεύσει το φάσμα των ακτινοβολιών που εκπέμπουν τα πολυηλεκτρονικά άτομα
• Δεν έχει την δυνατότητα να εξηγήσει τον χημικό δεσμό
• Ήταν σε αντίθεση με την ηλεκτρομαγνητική θεωρία (όπως και το πρότυπο του Rutherford). Με τη συνεχή κυκλική κίνηση του ηλεκτρονίου θα είχαμε συνεχώς απώλεια ενέργιας και το ηλεκτρόνιο τελικά θα έπεφτε στον πυρήνα.
Ο Bohr προκειμένου να συνδυάσει αυτές τις δύο ασυμβίβαστες θεωρίες εισήγαγε την Αρχή της Αντιστοιχίας σύμφωνα με την οποία «η κβαντική δίνει τα ίδια αποτελέσματα με την κλασσική στα όρια πολύ μεγάλων κύριων κβαντικών αριθμών n». Για το άτομο του υδρογόνου με τιμή n=1000 αντιστοιχεί τροχιά περίπου 1cm και ενεργιακά είναι πολύ κοντά στην ενέργια ιοντισμού.
Τα μειονεκτήματα της θεωρίας του Bohr ήταν τα εξής:
• Δεν εξηγούσε τη λεπτή υφή του φάσματος υδρογόνου. Αυτή εξηγήθηκε αργότερα από τον Sommerfeld με τη σχετικιστική φυσική
• Δεν μπόρεσε να ερμηνεύσει το φάσμα των ακτινοβολιών που εκπέμπουν τα πολυηλεκτρονικά άτομα
• Δεν έχει την δυνατότητα να εξηγήσει τον χημικό δεσμό







Δεν υπάρχουν σχόλια:
Δημοσίευση σχολίου
Σημείωση: Μόνο ένα μέλος αυτού του ιστολογίου μπορεί να αναρτήσει σχόλιο.